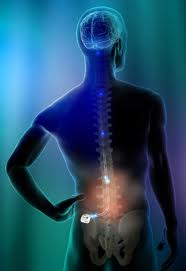
Η διέγερση του νωτιαίου μυελού είναι μία θεραπεία νευροτροποποίησης. Ο όρος νευροτροποποίηση αναφέρεται σε θεραπείες οι οποίες μέσω ηλεκτρικής ή χημικής μεταβολής της μετάδοσης ενός σήματος στο νευρικό σύστημα, διεγείρουν, αναστέλλουν ή συντονίζουν τη δραστηριότητα των νευρώνων ή των νευρωνικών δικτύων.
Με τον τρόπο αυτό τα σήματα του πόνου διακόπτονται και μεταβάλλονται κατά τη διαδρομή τους από το νωτιαίο μελό στον εγκέφαλο. Ο ασθενής δεν αισθάνεται πλέον τον πόνο και στη θέση του αισθάνεται μια ευχάριστη ελαφριά παραισθησία.
Για την αντιμετώπιση του χρόνιου πόνου, η νευροτροποποίηση μπορεί να εφαρμοστεί με διέγερση του νωτιαίου μυελού, περιφερική νευροδιέγερση και με υπαραχνοειδή έγχυση φαρμάκων, μέσω κατάλληλων εμφυτεύσιμων συστημάτων για την επίτευξη θεραπευτικού αποτελέσματος.
ΣΕ ΠΟΙΟΝ ΑΝΑΦΕΡΟΝΤΑΙ ΟΙ ΘΕΡΑΠΕΙΕΣ ΝΕΥΡΟΤΡΟΠΟΠΟΙΗΣΗΣ
Οι θεραπείες νευροτροποποίησης αναφέρονται σε κατάλληλα επιλεγμένους ασθενείς με χρόνιο πόνο, οι οποίοι:
• δεν μπορούν να ανακουφιστούν επαρκώς με φαρμακευτική αγωγή ή με άλλες λιγότερο επεμβατικές μεθόδους,
• εμφανίζουν σημαντικές παρενέργειες από τη λήψη φαρμάκων
• σε ασθενείς στους οποίους η χειρουργική επέμβαση αντενδείκνυται ή δεν αναμένεται να έχει τα επιθυμητά αποτελέσματα
• σε ασθενείς στους οποίους ο πόνος εμμένει μετά από χειρουργική επέμβαση
Πρόκειται για αντιστρεπτές θεραπείες, οι οποίες εφαρμόζονται μετά από δοκιμαστική περίοδο κατά την οποία ο ασθενής έχει παρατηρήσει σημαντική ανακούφιση από τον πόνο.
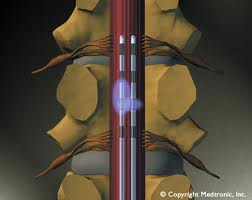
Για την εφαρμογή της διέγερσης νωτιαίου μυελού, ένα ή παραπάνω ηλεκτρόδια εμφυτεύονται με τοπική αναισθησία και ακτινοσκοπική καθοδήγηση στον επισκληρίδιο χώρο, στο οπίσθιο κέρας του νωτιαίου μυελού, και σε επίπεδο το οποίο αντιστοιχεί στο δερμοτόμιο όπου παρουσιάζεται ο πόνος. Τα ηλεκτρόδια συνδέονται μέσω υποδόριας διαδρομής με εμφυτεύσιμη γεννήτρια. Η ηλεκτρική ενέργεια που παράγεται από τη γεννήτρια εφαρμόζεται μέσω των ηλεκτροδίων στις κατάλληλες περιοχές του νωτιαίου μυελού.
Εναλλακτικά, σε ορισμένες περιπτώσεις, μπορεί να εφαρμοστεί περιφερική νευροδιέγερση ή συνδυασμός νωτιαίας και περιφερικής διέγερσης. Στην περίπτωση της περιφερικής διέγερσης, ένα ή παραπάνω ηλεκτρόδια τοποθετούνται υποδόρια στην περιοχή που εντοπίζεται ο πόνος και συνδέονται επίσης μέσω υποδόριας διαδρομής με εμφυτεύσιμη γεννήτρια. Η παραγόμενη ηλεκτρική ενέργεια επιδρά στα περιφερικά νεύρα με στόχο τη μείωση του πόνου.
Για την αξιολόγηση του θεραπευτικού αποτελέσματος της νευροδιέγερσης, πραγματοποιείται δοκιμαστική νευροδιέγερση λίγων ημερών. Εφόσον ο ίδιος ο ασθενής διαπιστώσει σημαντική ανακούφιση (>50%) και δώσει τη συγκατάθεσή, ακολουθεί η εμφύτευση του μόνιμου συστήματος. Σε περίπτωση που δεν επιτευχθεί ικανοποιητικό αποτέλεσμα, τότε απλά αποσύρεται το ή τα ηλεκτρόδια που είχαν τοποθετηθεί. Πρόκειται για μια πλήρως αντιστρέψιμη θεραπεία, κάθε σύστημα νευροδιέγερσης μπορεί ανά πάσα στιγμή να αφαιρεθεί σε περίπτωση ανάγκης χωρίς καμία παρενέργεια.
Ο προγραμματισμός του συστήματος γίνεται τηλεμετρικά με ειδικό προγραμματιστή, υπάρχει δυνατότητα αλλαγής και εφαρμογής διαφόρων συνδυασμών ώστε ο ασθενής να λαμβάνει το βέλτιστο θεραπευτικό αποτέλεσμα. Ο ίδιος ο ασθενής φέρει και αυτός προγραμματιστή τσέπης τον οποίο μπορεί να διακόπτει, να ενεργοποιεί και να αυξομειώνει την ένταση του διεγέρτη.
ΑΠΟΛΥΤΕΣ ΕΝΔΕΙΞΕΙΣ
Νευροπαθητικός πόνος
• Ριζοπάθειες με ή χωρίς πόνο στη μέση (χρόνια ισχιαλγία)
• Σύνδρομο Εμμένοντος Πόνου μετά από χειρουργική επέμβαση στη σπονδυλική στήλη (FBSS) (2,10,12,13,14))
• CRPS-Αλγοδυστροφία: (Σύνδρομο Περίπλοκου Περιοχικού Πόνου) (30,31,32,33,34,35,36,37)
τύπου Ι (αντανακλαστική συμπαθητική δυστροφία)
τύπου ΙΙ (καυσαλγία )
ΑΛΛΕΣ ΕΝΔΕΙΞΕΙΣ :
Ισχαιμικός πόνος (51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66)
• Εμμένουσα φαρμακοανθεκτική σταθερή στηθάγχη
• Περιφερική αγγειοπάθεια (PVD)/ισχαιμία κάτω άκρων με πόνο
Νευροπαθητικός πόνος
• Διαβητική Περιφερική πολυνευροπάθεια (41,42,43,44)
• Περιφερική νευροπάθεια (μεθερπητική νευραλγία, πόνος μέλους φάντασμα, τραυματισμός περιφερικού νεύρου, κλπ) (38,39,40)
Νευροπαθητικός Πόνος
• Η νευροδιέγερση νωτιαίου μυελού αποδεικνύεται περισσότερο αποτελεσματική στην αντιμετώπιση του πόνου των κάτω άκρων σε σχέση με τις συντηρητικές θεραπείες καθώς και σε σχέση με την επανεπέμβαση στη σπονδυλική στήλη
• Η πρόσληψη φαρμάκων και η χρήση άλλων θεραπειών για την αντιμετώπιση του πόνου μειώνονται σημαντικά
• Η ποιότητα ζωής και η λειτουργικότητα των ασθενών βελτιώνονται σημαντικά σε συνάρτηση με τις πιθανές επιπλοκές
Ισχαιμικός Πόνος
• Μείωση του πόνου και βελτίωση της μικροκυκλοφορίας του ισχαιμικού άκρου καθώς και ανακούφιση από τον πόνο της στηθάγχης
• Σημαντική μείωση της πιθανότητας ακρωτηριασμού του ισχαιμικού άκρου σε σύγκριση με συντηρητική θεραπεία, ακόμα και σε σύγκριση με χειρουργικές τεχνικές επαναιμάτωσης
• Μείωση της πρόσληψης φαρμάκων για την αντιμετώπιση του πόνου
• Μείωση της ισχαιμίας του μυοκαρδίου και συνεπώς των ισχαιμικών επεισοδίων
• Βελτίωση της καρδιακής λειτουργίας και της ποιότητας ζωής
ΚΛΙΝΙΚΕΣ ΕΦΑΡΜΟΓΕΣ ΝΕΥΡΟΔΙΕΓΕΡΣΗΣ
ΒΙΒΛΙΟΓΡΑΦΙΑ
- 1
Shealy CN, Mortimer JT, Reswick JB. Electrical inhibition of pain by stimulation of the dorsal columns: preliminary clinical report. Anesth Analg. 1967;46:489–491.
- 2
Wilkinson HA. The Failed Back Surgery Syndrome: Etiology and Therapy. 2nd ed. Philadelphia, PA: Harper and Row; 1991.
- 3
Villavicencio AT, Leveque JC, Rubin L, Bulsara K, Gorecki JP. Laminectomy versus percutaneous electrode placement for spinal cord stimulation. Neurosurgery. 2000;46:399–405.
- 4
Barolat G, Sharan AD. Future trends in spinal cord stimulation. Neurol Res. 2000;22:279–284.
- 5
Kumar K, Toth C, Nath RK, Laing P. Epidural spinal cord stimulation for treatment of chronic pain—some predictors of success. A 15-year experience. Surg Neurol. 1998;50:110–120.
-
Van Buyten JP. Neurostimulation for chronic neuropathic back pain in failed back surgery syndrome. J Pain Symptom Manage. 2006;31:S25–29.
- 7
Devulder J, De Laat M, Van Bastelaere M, Rolly G. Spinal cord stimulation: a valuable treatment for chronic failed back surgery patients. J Pain Symptom Manage. 1997;13:296–301.
- 8
Barolat G. A prospective multicenter study to assess the efficacy of spinal cord stimulation utilizing a multi-channel radio-frequency system for the treatment of intractable low back and lower extremity pain. Initial considerations and methodology. Neuromodulation. 1999; 2:179–183.
Direct Link: - 9
Burchiel KJ, Anderson VC, Brown FD, et al. Prospective, multicenter study of spinal cord stimulation for relief of chronic back and extremity pain. Spine. 1996;21:2786–2794.
- 10
North RB, Guarino AH. Spinal cord stimulation for failed back surgery syndrome: technical advances, patient selection and outcome. Neuromodulation. 1999;2:171–178.
Direct Link: - 11
Van Buyten JP, Van Zundert J, Vueghs P, Vanduffel L. Efficacy of spinal cord stimulation: 10 years of experience in a pain centre in Belgium. Eur J Pain. 2001;5:299–307.
- 12
Taylor RS. Spinal cord stimulation in complex regional pain syndrome and refractory neuropathic back and leg pain/failed back surgery syndrome: results of a systematic review and meta-analysis. J Pain Symptom Manage. 2006;31:S13–S19.
- 13
North RB, Kidd DH, Farrokhi F, Piantadosi SA. Spinal cord stimulation versus repeated lumbosacral spine surgery for chronic pain: a randomized, controlled trial. Neurosurgery. 2005;56:98–106.
- 14
Kumar K, Taylor R, Jacques L, et al. Spinal cord stimulation versus conventional medical management for neuropathic pain: a multicentre randomized controlled trial in patients with failed back surgery syndrome. Pain. 2007;132:179–188.
- 15
Barolat G. Epidural spinal cord stimulation: anatomical and electrical properties of the intraspinal structures relevant to spinal cord stimulation and clinical correlations. Neuromodulation. 1998;1:63–71.
- 16
Barolat G, Oakley JC, Law JD, North RB, Ketcik B, Sharan A. Epidural spinal cord stimulation with a multiple electrode paddle lead is effective in treating intractable low back pain. Neuromodulation. 2001;4:59–66.
Direct Link: - 17
Deer T, Krames E, Hassenbusch S, et al. Management of IT catheter-tip inflammatory masses: an updated 2007 consensus statement from an expert panel. Neuromodulation. 2008;11:77–91.
Direct Link: - 18
Bernstein CA, Paicius RM, Barkow SH. Spinal cord stimulation in conjunction with peripheral nerve field stimulation for the treatment of low back and leg pain: a case series. Neuromodulation. 2008;11:116–123.
Direct Link: - 19
Chandler GS 3rd, Nixon B, Stewart LT, Love J. Dorsal column stimulation for lumbar spinal stenosis. Pain Physician. 2003;6:113–118.
- 20
Amundsen T, Weber H, Nordal HJ, Magnaes B, Abdelnoor M, Lilleas F. Lumbar spinal stenosis: conservative or surgical management?: a prospective 10-year study. Spine. 2000;25:1424–1435.
- 21
Barolat G. Experience with 509 plate electrodes implanted epidurally from C1 to L1. Stereotact Funct Neurosurg. 1993;61:60–79.
- 22
North RB, Kidd DH, Olin JC, Sieracki JM. Spinal cord stimulation electrode design: prospective, randomized, controlled trial comparing percutaneous and laminectomy electrodes-part I: technical outcomes. Neurosurgery. 2002;51:381–390.
- 23
Rosenow JM, Stanton-Hicks M, Rezai AR, Henderson JM. Failure modes of spinal cord stimulation hardware. J Neurosurg Spine. 2006;5:183–190.
- 24
Henderson JM, Schade CM, Sasaki J, Caraway DL, Oakley JC. Prevention of mechanical failures in implanted spinal cord stimulation systems. Neuromodulation. 2006;9:183–191.
Direct Link: - 25
Sharan A, Cameron T, Barolat G. Evolving patterns of spinal cord stimulation in patients implanted for intractable low back and leg pain. Neuromodulation. 2002;5:167–179.
Direct Link: - 26
North RB, Kidd DH, Olin J, et al. Spinal cord stimulation for axial low back pain: a prospective, controlled trial comparing dual with single percutaneous electrodes. Spine. 2005;30:1412–1418.
- 27
Mekhail NA, Aeschbach A, Stanton-Hicks M. Cost benefit analysis of neurostimulation for chronic pain. Clin J Pain. 2004;20:462–468.
- 28
Taylor RS, Taylor RJ, Van Buyten JP, Buchser E, North R, Bayliss S. The cost effectiveness of spinal cord stimulation in the treatment of pain: a systematic review of the literature. J Pain Symptom Manage. 2004;27:370–378.
- 29
Kumar K, Malik S, Demeria D. Treatment of chronic pain with spinal cord stimulation versus alternative therapies: cost-effectiveness analysis. Neurosurgery. 2002;51:106–115.
- 30
Oaklander AL, Rissmiller JG, Gelman LB, Zheng L, Chang Y, Gott R. Evidence of focal small-fiber axonal degeneration in complex regional pain syndrome-I (reflex sympathetic dystrophy). Pain. 2006;120:235–243.
- 31
Harke H, Gretenkort P, Ladleif HU, Rahman S. Spinal cord stimulation in sympathetically maintained complex regional pain syndrome type I with severe disability. A prospective clinical study. Eur J Pain. 2005;9:363–373.
- 32
Oakley JC, Weiner RL. Spinal cord stimulation for complex regional pain syndrome: a prospective study of 19 patients at two centers. Neuromodulation. 1999;2:47–50.
Direct Link: - 33
Barolat G, Schartzman R, Woo R. Epidural spinal cord stimulation in the management of reflex sympathetic dystrophy. Stereotact Funct Neurosurg. 1989;53:29–39.
- 34
Kemler MA, Barendse GA, Van Kleef M, Egbrink MG. Pain relief in complex regional pain syndrome due to spinal cord stimulation does not depend on vasodilatation. Anesthesiology. 2000;92:1653–1660.
- 35
Hassenbusch SJ, Stanton-Hicks M, Schoppa D, Walsh JG, Covington EC. Long-term results of peripheral nerve stimulation for reflex sympathetic dystrophy. J Neurosurg. 1996;84:415–423.
- 36
Kemler MA, Barendse GA, Van Kleef M, et al. Spinal cord stimulation in patients with chronic reflex sympathetic dystrophy. N Engl J Med. 2000;343:618–624.
- 37
Stanton-Hicks M. Complex regional pain syndromes: manifestations and the role of neurostimulation in its management. J Pain Symptom Manage. 2006;31:S20–24.
- 38
Meglio M, Cioni B, Prezioso A, Talamonti G. Spinal cord stimulation (SCS) in the treatment of postherpetic pain. Acta Neurochir Suppl (Wien). 1989;46:65–66.
- 39
Harke H, Gretenkort P, Ladleif HU, Koester P, Rahman S. Spinal cord stimulation in postherpetic neuralgia and in acute herpes zoster pain. Anesth Analg. 2002;94:694–700.
- 40
Johnson MD, Burchiel KJ. Peripheral stimulation for treatment of trigeminal postherpetic neuralgia and trigeminal posttraumatic neuropathic pain: a pilot study. Neurosurgery. 2004;55:135–141.
-
Tesfaye S, Watt J, Benbow SJ, Pang KA, Miles J, MacFarlane IA. Electrical spinal-cord stimulation for painful diabetic peripheral neuropathy. Lancet. 1996;348:1698–1701.
- 42
Daousi C, Benbow SJ, MacFarlane IA. Electrical spinal cord stimulation in the long-term treatment of chronic painful diabetic neuropathy. Diabet Med. 2005;22:393–398.
Direct Link: - 43
Hamza MA, White PF, Craig WF, et al. Percutaneous electrical nerve stimulation: a novel analgesic therapy for diabetic neuropathic pain. Diabetes Care. 2000;23:365–370.
- 44
Kapural L, Hayek SM, Stanton-Hicks M, Mekhail N. Decreased insulin requirements with spinal cord stimulation in a patient with diabetes. Anesth Analg. 2004;98:745–746.
- 45
Weiner RL. Occipital neurostimulation (ONS) for treatment of intractable headache disorders. Pain Med. 2006;7:S137–139.
Direct Link: - 46
Slavin KV, Nersesyan H, Wess C. Peripheral neurostimulation for treatment of intractable occipital neuralgia. Neurosurgery. 2006;58:112–119.
- 47
Kapural L, Mekhail N, Hayek SM, Stanton-Hicks M, Malak O. Occipital nerve electrical stimulation via the midline approach and subcutaneous surgical leads for treatment of severe occipital neuralgia: a pilot study. Anesth Analg. 2005;101:171–174.
- 48
- 49
Stinson LW, Roderer GT, Cross NE, Davis BE. Peripheral subcutaneous electrostimulation for control of intractable post-operative inguinal pain: a case report series. Neuromodulation. 2001;4:99–104.
Direct Link: - 50
Goroszeniuk T, Kothari S, Hamann W. Subcutaneous neuromodulation implant targeted at the site of pain. Reg Anesth Pain Med. 2006;31:168–171.
- 51
Deer TR, Raso LJ. Spinal cord stimulation for refractory angina pectoris and peripheral vascular disease. Pain Physician. 2006;9:347–352.
- 52
Ghajar AW, Miles JB. The differential effect of the level of spinal cord stimulation on patients with advanced peripheral vascular disease in the lower limbs. Br J Neurosurg. 1998;12:402–408.
- 53
Linderoth B. Spinal cord stimulation in ischemia and ischemic pain: possible mechanisms of action. In: HorschS, ClaeysL, eds. Spinal Cord Stimulation. An Innovative Method in the Treatment of PVD and Angina. Darmstadt: Steinkopff Verlag; 1995:19–35.
- 54
Ubbink DT, Vermeulen H, Spincemaille GH, Gersbach PA, Berg P, Amann W. Systematic review and meta-analysis of controlled trials assessing spinal cord stimulation for inoperable critical leg ischaemia. Br J Surg. 2004;91:948–955.
Direct Link: - 55
Petrakis IE, Sciacca V. Spinal cord stimulation in critical limb ischemia of the lower extremities: our experience. J Neurosurg Sci. 1999;43:285–293.
- 56
Mannheimer C, Eliasson T, Andersson B, et al. Effects of spinal cord stimulation in angina pectoris induced by pacing and possible mechanisms of action. BMJ. 1993;307:477–480.
- 57
Greco S, Auriti A, Fiume D, et al. Spinal cord stimulation for the treatment of refractory angina pectoris: a two-year follow-up. Pacing Clin Electrophysiol. 1999;22:26–32.
Direct Link: - 58
Hautvast RW, DeJongste MJ, Staal MJ, Van Gilst WH, Lie KI. Spinal cord stimulation in chronic intractable angina pectoris: a randomized, controlled efficacy study. Am Heart J. 1998;136:1114–1120.
-
Eliasson T, Augustinsson L, Mannheimer C. Spinal cord stimulation in severe angina pectoris—presentation of current studies, indications, and clinical experience. Pain. 1996;65:169–179.
- 60
DeJongste MJ. Spinal cord stimulation for ischemic heart disease. Neurol Res. 2000;22:293–298.
- 61
TenVaarwerk I, Jessurun G, DeJongste MJ, et al. Clinical outcome of patients treated with spinal cord stimulation for therapeutically refractory angina pectoris. Heart. 1999;82:82–88.
- 62
Ekre O, Eliasson T, Norrsell H, Wahrborg P, Mannheimer C. Long-term effects of spinal cord stimulation and coronary artery bypass grafting on quality of life and survival in the ESBY study. Eur Heart J. 2002;23:1938–1945.
- 63
Chauhan A, Mullins PA, Thursraisingham SI, Taylor G, Petch MC, Schofeld PM. Effect of transcutaneous electrical nerve stimulation on coronary blood flow. Circulation. 1994;89:694–702.
- 64
Mobilia G, Zuin G, Zanco P, et al. Effects of spinal cord stimulation on regional myocardial blood flow in patients with refractory angina. A positron emission tomography study. G Ital Cardiol. 1998;28:1113–1119.
- 65
Diedrichs H, Zobel C, Theissen P, et al. Symptomatic relief precedes improvement of myocardial blood flow in patients under spinal cord stimulation. Curr Control Trials Cardiovasc Med. 2005;6:7.
- 66
Murray S, Carson KG, Ewings PD, Collins PD, James MA. Spinal cord stimulation significantly decreases the need for acute hospital admission for chest pain in patients with refractory angina pectoris. Heart. 1999;82:89–92.
- 67
Cervero F. Neurophysiology of gastrointestinal pain. Baillieres Clin Gastroenterol. 1988;2:183–199.
- 68
Palecek J. The role of dorsal columns pathway in visceral pain. Physiol Res. 2004;53(suppl 1):S125–S130.
- 69
Greenwood-Van Meerveld B, Johnson AC, Foreman RD, Linderoth B. Spinal cord stimulation attenuates visceromotor reflexes in a rat model of post-inflammatory colonic hypersensitivity. Auton Neurosci. 2005;122:69–76.
- 70
Qin C, Lehew RT, Khan KA, Wienecke GM, Foreman RD. Spinal cord stimulation modulates intraspinal colorectal visceroreceptive transmission in rats. Neurosci Res. 2007;58:58–66.
- 71
Krames ES, Foreman R. Spinal cord stimulation modulates visceral nociception and hyperalgesia via the spinothalamic tracts and the postsynaptic dorsal column pathways: a literature review and hypothesis. Neuromodulation. 2007;10:224–237.
Direct Link: - 72
Cervero F, Connell LA, Lawson SN. Somatic and visceral primary afferents in the lower thoracic dorsal root ganglia of the cat. J Comp Neurol. 1984;228:422–431.
Direct Link: - 73
Peters KM. Neuromodulation for the treatment of refractory interstitial cystitis. Rev Urol. 2002;4:S36–S43.
- 74
Elabbady AA, Hassouna MM, Elhilali MM. Neural stimulation for chronic voiding dysfunctions. J Urol. 1994;152:2076–2080.
- 75
Khan YN, Raza SS, Khan EA. Spinal cord stimulation in visceral pathologies. Pain Med. 2006;7:S121–S125.
Direct Link: - 76
Whiteside JL, Walters MD, Mekhail N. Spinal cord stimulation for intractable vulvar pain. A case report. J Reprod Med. 2003;48:821–823.
- 77
Ceballos A, Cabezudo L, Bovaira M, Fenollosa P, Moro B. Spinal cord stimulation: a possible therapeutic alternative for chronic mesenteric ischemia. Pain. 2000;87:99–101.
- 78
Jackson M, Simpson KH. Spinal cord stimulation in a patient with persistent oesophageal pain. Pain. 2004;112:406–408.
- 79
Khan YN, Raza SS, Khan EA. Application of spinal cord stimulation for the treatment of abdominal visceral pain syndromes: case reports. Neuromodulation. 2005;8:14–27.
Direct Link: - 80
Kapural L, Narouze SN, Janicki TI, Mekhail N. Spinal cord stimulation is an effective treatment for the chronic intractable visceral pelvic pain. Pain Med. 2006;7:440–443.
Direct Link: - 81
Tiede JM, Ghazi SM, Lamer TJ, Obray JB. The use of spinal cord stimulation in refractory abdominal visceral pain: case reports and literature review. Pain Pract. 2006;6:197–202.
Direct Link: - 82
Kapural L, Rakic M. Spinal cord stimulation for chronic visceral pain secondary to chronic non-alcoholic pancreatitis: a case report. Clin Gastroenterol Hepatol. 2008;42:750–751.
- 83
Krames E, Mousad DG. Spinal cord stimulation reverses pain and diarrheal episodes of irritable bowel syndrome: a case report. Neuromodulation. 2004;7:82.
Direct Link: - 84
Feler CA, Whitworth LA, Brookoff D, Powell R. Recent advances: sacral nerve root stimulation using a retrograde method of lead insertion for the treatment of pelvic pain due to interstitial cystitis. Neuromodulation. 1999;2:211–216.
Direct Link: - 85
Comiter CV. Sacral neuromodulation for symptomatic treatment of refractory interstitial cystitis: a prospective study. J Urol. 2003;169:1369–1373.
- 86
Maher CF, Carey MP, Dwyer PL, Schluter PI. Percutaneous sacral nerve root neuromodulation for intractable interstitial cystitis. J Urol. 2001;165:884–886.
- 87
Chai TC, Zhang C, Warren JW, Keay S. Percutaneous sacral third nerve root neurostimulation improves symptoms and normalizes urinary HB-EGF levels and antiproliferative activity in patients with interstitial cystitis. Urology. 2000;55:643–646.
- 88
Sherman ND, Amundsen CL. Current and future techniques of neuromodulation for bladder dysfunction. Curr Urol Rep. 2007;8:448–454.
- 89
Alo KM, Gohel R, Corey CL. Sacral nerve root stimulation for the treatment of urge incontinence and detrusor dysfunction utilizing a cephalocaudal intraspinal method of lead insertion: a case report. Neuromodulation. 2001;4:53–58.
Direct Link: - 90
Ganio E, Luc AR, Clerico G, Trompetto M. Sacral nerve stimulation for treatment of fecal incontinence: a novel approach for intractable fecal incontinence. Dis Colon Rectum. 2001;44:619–629.
- 91
Kenefick NJ, Vaizey CJ, Cohen RC, Nicholls RJ, Kamm MA. Medium-term results of permanent sacral nerve stimulation for faecal incontinence. Br J Surg. 2002;89:896–901.
Direct Link: - 92
Bemelmans BL, Mundy AR, Craggs MD. Neuromodulation by implant for treating lower urinary tract symptoms and dysfunction. Eur Urol. 1999;36:81–91.
- 93
Shaker HS, Hassouna M. Sacral root neuromodulation in idiopathic nonobstructive chronic urinary retention. J Urol. 1998;159:1476–1478.